兽医科技
2022-04-14 18:35:49
传染性法氏囊病病毒(IBDV)是双RNA病毒科的重要代表。IBDV超强毒株可导致感染鸡的中枢免疫器官法氏囊组织和B淋巴细胞严重损伤,使鸡群发生严重的免疫抑制和60%以上的急性死亡。而由超强毒株致弱的弱毒株对鸡不致病、不致死。IBDV强、弱毒株的关键结构差异尚未被解析,其组装和入侵的分子机制也有待进一步揭示。
近日,中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室禽免疫抑制病创新团队和中国科学院生物物理研究所生物大分子国家重点实验室在Science Bulletin上发表了“Cryo-EM structures of infectious bursal disease viruses with different virulences provide insights into their assembly and invasion”的研究论文。该研究利用冷冻电镜三维重构技术分别解析了IBDV超强毒株 Gx和弱毒株Gt全病毒的3.3 Å和3.2 Å的高分辨率结构,揭示了不同毒力毒株关键结构特征及其差异,阐释了IBDV组装和入侵相关机制。
本研究解析的IBDV T =13 全病毒结构揭示了与病毒组装稳定性相关的重要结构原件,发现具有保护性抗原作用的病毒衣壳蛋白VP2的N末端与邻近的VP2三聚体S结构域的β束SF相互作用,形成β折叠,将相邻的VP2三聚体“拴”在一起;邻近的VP2三聚体的P结构域之间存在相互作用,该相互作用由IBDV不同毒株间保守的Q219和Q324介导;VP2的SDE loop因富含保守的疏水性氨基酸而在病毒颗粒伪六次轴处存在疏水相互作用。这些结构有助于提高病毒组装的稳定性。
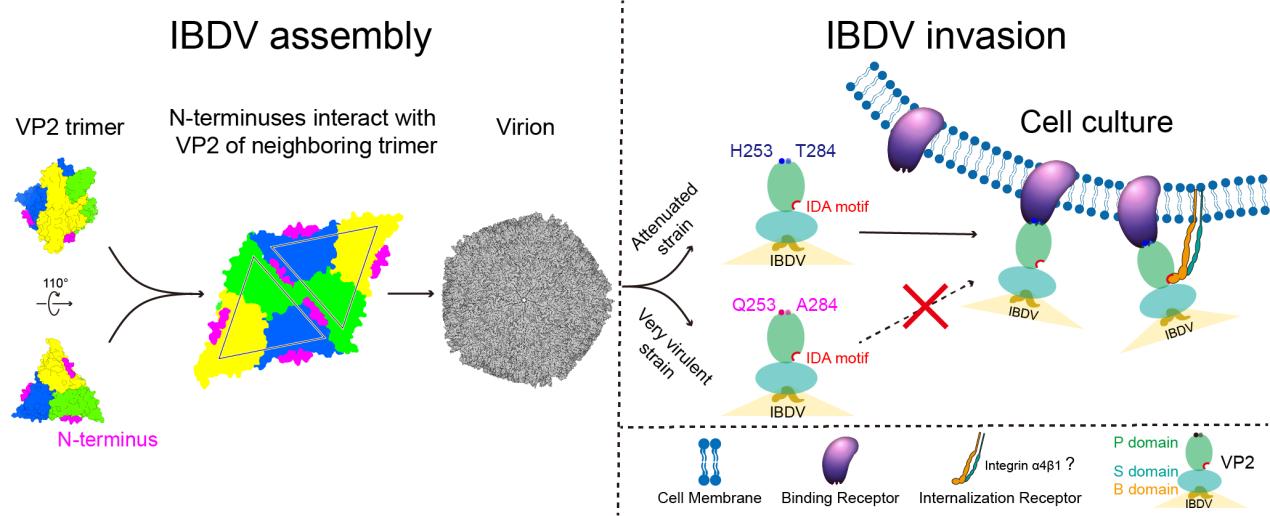
冷冻电镜三维结构解析发现,与IBDV超强毒株相比,弱毒株VP2 P结构域的H253和T284之间形成氢键,并呈现正表面电势,提示253/284突变以及相应的表面电势的改变,可能是不同毒株细胞嗜性改变导致病毒复制及致病性差异的重要机制。进而发现,IBDV VP2蛋白结构表面具有一个呈负表面电势的凹槽,凹槽内含有整合素结合基序IDA,在IBDV的入侵过程中发挥重要作用。本研究对于深入认知IBDV强、弱毒及双RNA病毒的组装、侵染和致病机制有重要意义。
中国科学院生物物理研究所包珂岩博士和中国农业科学院哈尔滨兽医研究所祁小乐研究员为论文共同第一作者,中科院生物物理研究所朱平研究员和中国农科院哈尔滨兽医研究所王笑梅研究员为共同通讯作者。该研究得到国家自然科学基金(U20A2061、31730023、31521002、32072852)、中国科学院战略重点研究发展计划(XDB37010100)、兽医生物技术国家重点实验室重点项目(SKLVBF201702)、生物大分子国家重点实验室项目(2020KF12)等的资助。
文章链接:
https://www.sciencedirect.com/science/article/abs/pii/S2095927321007611


